เคมีอินทรีย์ และผลิตภัณฑ์ปิโตรเลียม
1. เคมีอินทรีย์ (Organic Chemistry)
หมายถึงสาขาวิชาที่เกี่ยวข้องกับการศึกษาเกี่ยวกับชนิด สมบัติ การสังเคราะห์ และปฏิกิริยาของสารประกอบอินทรีย์
สารอินทรีย์หมายถึงสารประกอบที่มีธาตุคาร์บอนเป็นองค์ประกอบ ทั้งที่เกิดจากสิ่งมีชีวิต และจากการสังเคราะห์ ยกเว้นสารต่อไปนี้ ซึ่งเป็นสารอนินทรีย์

Friedrich Wöhlerจากการศึกษาสารประกอบทั่ว ๆ ไป มักจะมีธาตุคาร์บอนเป็นองค์ประกอบ นักเคมีในยุคก่อนเชื่อว่าสารที่มีคาร์บอนเป็นองค์ประกอบต้องมาจากสิ่งมีชีวิตเท่านั้น และเรียกสารเหล่านี้ว่า สารประกอบอินทรีย์ จนกระทั่งปี พ.ศ. 2371 (ค.ศ.1828) ฟรีดริช เวอเลอร์ นักเคมีชาวเยอรมันสามารถสังเคราะห์สารอินทรีย์ได้จากสารอนินทรีย์ โดยสังเคราะห์ยูเรียซึ่งเป็นสารอินทรีย์จากการเผาแอมโมเนียมไซยาเนต (NH4OCN) ซึ่งเป็นสารอนินทรีย์ ดังสมการ NH4OCN(s) ----------> H2NCONH2(s)
ต่อมามีนักเคมีที่สามารถสังเคราะห์สารอินทรีย์ได้มากขึ้น จึงทำให้แนวคิดเกี่ยวกับสารอินทรีย์เปลี่ยนไปปัจจุบันจากการศึกษาสารประกอบทั่ว ๆ ไป มักจะมีธาตุคาร์บอนเป็นองค์ประกอบ นักเคมีในยุคก่อนเชื่อว่าสารที่มีคาร์บอนเป็นองค์ประกอบต้องมาจากสิ่งมีชีวิตเท่านั้น และเรียกสารเหล่านี้ว่า สารประกอบอินทรีย์
2. พันธะของคาร์บอน
เวเลนซ์อิเล็กตรอนทั้ง 4 ของคาร์บอนสามารถเกิดพันธะโคเวเลนซ์ (covalent bond) ได้ 4 พันธะ ซึ่งอาจจะเป็นพันธะเดี่ยว (single bond) พันธะคู่ (double bond) หรือพันธะสาม (triple bond) ก็ได้ การเกิดพันธะของคาร์บอนสามารถเกิดได้ 3 แบบ ดังนี้
พันธะเดี่ยว 4 พันธะ
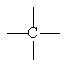
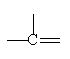
พันธะคู่ 1 พันธะ + พันธะเดี่ยว 2 พันธะ
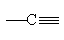
พันธะสาม 1 พันธะ + พันธะเดี่ยว 1 พันธะ
ความยาวพันธะระหว่างคาร์บอน - คาร์บอน เรียงจากน้อยไปมาก ดังนี้

พลังงานพันธะ900 600 300 kJ/molอะตอมอื่นๆ ที่มาร่วมใช้เวเลนซ์อิเล็กตรอนเกิดพันธะโคเวเลนซ์กับคาร์บอนในสารอินทรีย์ ธาตุที่พบมากที่สุด คือ ไฮโดรเจน (H) สำหรับธาตุอื่นๆ นอกจาก H แล้วยังมี ไนโตรเจน (N) , ฟอสฟอรัส (P), ออกซิเจน (O), กำมะถัน (S) และแฮโลเจน (F, Cl, Br, I) ตัวอย่างพันธะโคเวเลนต์ระหว่างคาร์บอนกับธาตุอื่นๆ ที่พบบ่อยในสารอินทรีย์ ดังนี้
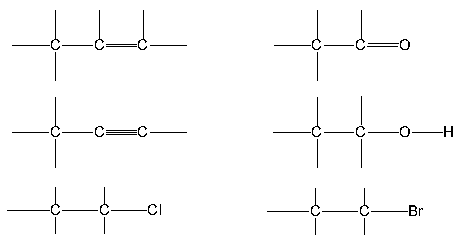
ดังนั้นเมื่อเขียนสูตรสารอินทรีย์และมีอะตอมข้างบนนี้เข้ามาเกี่ยวข้องต้องพิจารณาจำนวนพันธะให้ถูกต้อง
กรดคาร์บอกซิลิก (Carboxylic acid)
กรดคาร์บอกซิลิก เป็นสารประกอบอินทรีย์ที่ประกอบด้วยธาตุ C H และ O โดยมีหมู่ฟังก์ชันคือหมู่คาร์บอกซิล (carboxyl : หรือ ) มีสูตรทั่วไปเป็น RCOOH หรือ หรือ RCO2H หรือ CnH2nO2เมื่อ R เป็นหมู่แอลคิล หมู่แอริล หรือไฮโดรเจน
การเรียกชื่อกรดคาร์บอกซิลิก
ชื่อสามัญ
1) ชื่อสามัญของกรดคาร์บอกซิลิก มักจะตั้งตามชื่อของสิ่งมีชีวิตหรือสิ่งของที่พบกรดชนิดนั้น เช่น กรดฟอร์มิก (formic acid) มาจากคำว่า fomica ในภาษาละตินที่มีความหมายว่า “มด” กรดแอซีติก (acetic acid) มาจากคำว่า acetumในภาษาละตินที่มีความหมายว่า “เปรี้ยว”2. การเรียกชื่อสามัญของกรดคาร์บอกซิลิกจะใช้อักษรกรีก เช่น แอลฟา (a) บีตา (b) และแกมมา (g) ระบุตำแหน่งของคาร์บอนที่ต้อกับหมู่คาร์บอกซิลตำแหน่งที่ 1 , 2 และ 3 ตามลำดับ เช่น
ดังนั้น กรดแอลฟาไฮดรอกซี จึงหมายกรดคาร์บอกซิลกที่มีหมู่ไฮดรอกซิล (-OH) ต่ออยู่กับอะตอมของคาร์บอนที่ตำแหน่งแอลฟา
กรดฟอร์มิก (Formic acid)
การเรียกชื่อระบบ IUPAC
การเรียกชื่อกรดคาร์บอกซิลิกที่เป็นโซ่ตรง ให้เรียกตามจำนวนอะตอมคาร์บอน แล้วลงท้ายเสียงเป็น –อาโนอิก (–anoic acid) เช่น
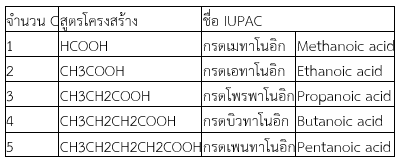
กรดแอซีติก (กรดเอทาโนอิก)
กรดแอซีติก
กรดโพรพาโนอิก
3. สูตรโครงสร้างของสารอินทรีย์
การเขียนสูตรของสารประกอบอินทรีย์
สูตรโมเลกุลเป็นสูตรที่บอกให้ทราบว่าในสารประกอบนั้นประกอบด้วยธาตุใดบ้างอย่างละกี่อะตอม ซึ่งไม่เป็นที่นิยมเขียนสูตรชนิดนี้ เช่น CH4, C6H14, C6H6O เป็นต้น สูตรโครงสร้างเป็นสูตรที่บอกให้ทราบว่าในโมเลกุลของสารประกอบนั้น ประกอบด้วยธาตุใดบ้างอย่างละกี่อะตอม แต่ละอะตอมยึดเหนี่ยวกันอย่างไร มีหลายแบบ ดังนี้
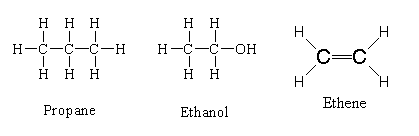
สูตรโครงสร้างแบบเส้น (Expanded form) สูตรโครงสร้างแบบย่อ (Condensed form) สูตรโครงสร้างแบบเส้นและมุม (Bond - line form) เป็นการเขียนสูตรโครงสร้างโดยใช้เส้นขีด(-)แทนอิเล็กตรอน 2 ตัว หรือ 1 คู่ในการเขียนแสดงพันธะโคเวเลนต์ เช่น สูตรโครงสร้างแบบเส้น
สูตรโครงสร้างแบบย่อ (Condensed form)เป็นสูตรโครงสร้างที่ไม่แสดงเส้นพันธะเดี่ยวระหว่างไฮโดรเจนกับคาร์บอน โดยจะใช้วงเล็บย่อตัวที่เหมือนกันไว้ด้วยกัน เช่น
สูตรโครงสร้างแบบเส้นและมุม (Bond-line form) เป็นสูตรโครงสร้างที่ไม่แสดงธาตุคาร์บอนและไฮโดรเจน แต่จะแสดงเส้นพันธะระหว่างคาร์บอนและไฮโดรเจนเท่านั้น
4. ไอโซเมอริซึม
ไอโซเมอริซึม(Isomerism) และ ไอโซเมอร์(Isomer)ไอโซเมอริซึมคือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกันแต่สูตรโครงสร้างต่างกัน ทำให้มีสมบัติต่างๆ เช่น จุดเดือด จุดหลอมเหลวแตกต่างกัน ไอโซเมอร์คือ สารที่มีสูตรโมเลกุลเหมือนกันแต่มีสูตรโครงสร้างต่างกันหลักการพิจารณาว่าสารเป็นไอโซเมอร์กันหรือไม่
ขั้นที่ 1 พิจารณาจำนวนธาตุว่าเท่ากันหรือไม่ ถ้าเท่ากันให้นับจำนวนอะตอมของแต่ละชนิดว่าเท่ากันหรือไม่ ถ้าเท่ากันทุกธาตุแสดงว่ามีสูตรโมเลกุลเหมือนกัน ให้พิจารณาขั้นที่ 2 ต่อไป
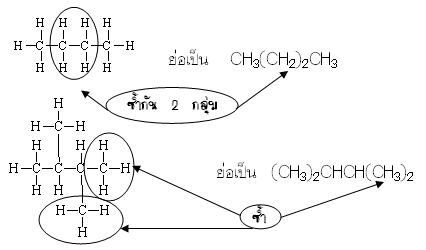
ขั้นที่ 2 พิจารณาว่ามีโครงสร้างที่ต่างกันหรือไม่ ถ้ามีโครงสร้างต่างกันแสดงว่าเป็นไอโซเมอร์กัน ในการพิจารณาโครงสร้างว่าเหมือนกันหรือต่างกันเป็นเรื่องค่อนข้างยาก เพราะสูตรโครงสร้างที่นักเรียนเห็นไม่ใช่โครงสร้างที่แท้จริง แต่เป็นสูตรโครงสร้างที่เขียนเพื่อความสะดวก เป็นโครงสร้างเพียง 2 มิติ แต่ความเป็นจริง เป็นโครงสร้าง 3 มิติเป็นส่วนใหญ่ ดังนั้นสูตรโครงสร้างที่เห็นว่าต่างกันจึงอาจเหมือนกันได้ ในการพิจารณาใช้หลัก ดังนี้"ให้ถือว่าโครงสร้างทั้งหลายเป็นเส้นลวดที่สามารถตัด พลิก หมุนได้ (เฉพาะส่วนที่เกิดพันธะเดี่ยว) แต่ห้ามตัดต่อ พลิก หรือหมุนแล้วทำให้เหมือนกันแสดงว่าเป็นโครงสร้างเดียวกัน"
หลักการเขียนไอโซเมอร์
สารอินทรีย์ที่มีคาร์บอนอะตอมประมาณ 3-4 อะตอมขึ้นไปสามารถเกิดไอโซเมอร์ที่มีโครงสร้างแบบต่างๆ กัน ถ้าคาร์บอนอะตอมมากขึ้นก็จะมีจำนวน ไอโซเมอร์เพิ่มขึ้น แต่จะมีจำนวนเท่าไรไม่มีสูตรที่จะใช้ในการคำนวณที่แน่นอนและจะทราบจำนวนไอโซเมอร์ของสารอินทรีย์ได้ต้องเขียนและพิจารณาเองโดยมีหลักการเขียน ดังนี้
1. การเขียนไอโซเมอร์ต้องเริ่มจากไอโซเมอร์ที่มีคาร์บอนต่อกันเป็นสายยาวที่สุดก่อน
2. ลดจำนวนคาร์บอนอะตอมทีละอะตอมลงในสายยาวของคาร์บอนที่ต่อกัน โดยนำมาต่อเป็นสาขาที่ตำแหน่งต่าง ๆ
3. ต้องระวังพิจารณาว่ารูปร่างโครงสร้างที่เขียนซ้ำหรือไม่ การเขียนก็ให้เขียนเฉพาะคาร์บอนอะตอมก่อนแล้วจึงเติมไฮโดรเจนที่หลัง แล้วเช็คดูว่าสูตรตรงกับที่โจทย์ให้หรือไม่\ชนิดของไอโซเมอร์
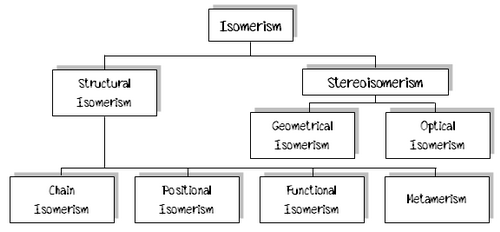
Structural Isomer คือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกันแต่มีสูตรโครงสร้างต่างกัน
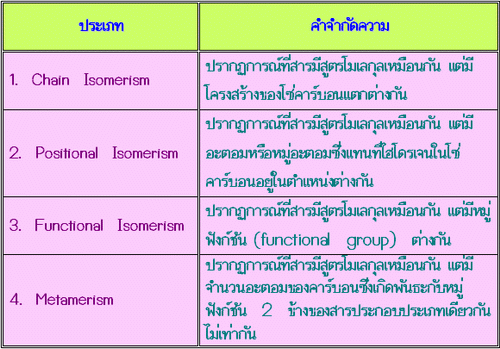
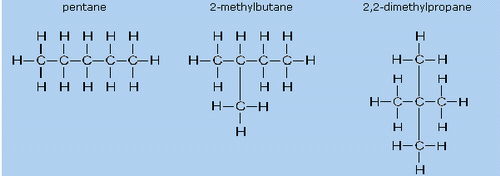
Chain Isomerism
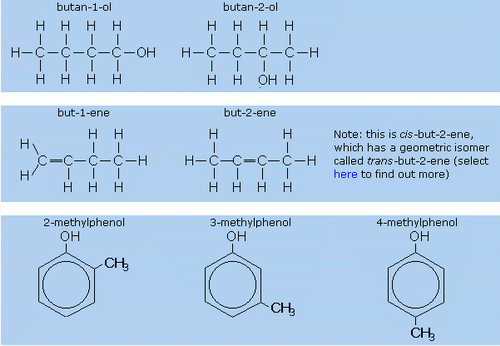
Positional Isomerism
Functional Isomerism
StereoIsomerismคือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกัน สูตรโครงสร้างเหมือนกันแต่มีการจัดเรียงตัวของอะตอมหรือหมู่อะตอมในที่ว่าง (space) ต่างกัน
GeometricIsomerism
Optical Isomerism
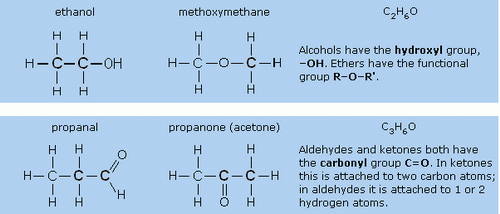
5. หมู่ฟังก์ชัน
หมู่ฟังก์ชัน (Functional group = หมู่อะตอมที่แสดงสมบัติเฉพาะ)
หมู่ฟังก์ชันคือหมู่อะตอมหรือกลุ่มอะตอมของธาตุที่แสดงสมบัติเฉพาะของสารอินทรีย์ชนิดหนึ่งๆ เช่น CH3OH (เมทานอล) CH3CH2OH (เอทานอล) ซึ่งต้องเป็นสารอินทรีย์พวกแอลกอฮอล์ เพราะสารแต่ละชนิดต่างก็มีหมู่ -OH เป็นองค์ประกอบ แสดงว่าหมู่ -OH เป็นหมู่ฟังก์ชันของแอลกอฮอล์
HCOOH (กรดเมทาโนอิก) และ CH3COOH (กรดเอทาโนอิก) ซึ่งต่างจากกรดอินทรีย์ เพราะสารทั้งสองต่างก็มีหมู่ -COOH เป็นองค์ประกอบ แสดงว่าหมู่ -COOH เป็นหมู่ฟังก์ชันของกรดอินทรีย์
อนึ่งสารอินทรีย์โดยทั่วไปประกอบด้วยองค์ประกอบ 2 ส่วน ส่วนหนึ่งเป็นอะตอมไฮโดรคาร์บอนหรือหมู่อะตอมอื่นๆ อีกส่วนหนึ่งเป็นหมู่ฟังก์ชัน ซึ่งแสดงสมบัติเฉพาะของสารอินทรีย์นั้น และเป็นส่วนที่มีความว่องไวทางเคมี ดังรูป
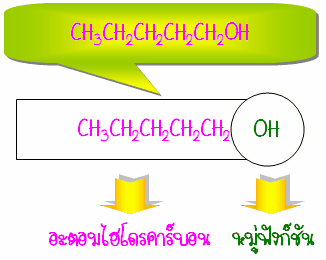
ปฏิกิริยาเคมีที่เกิดกับสารอินทรีย์มักจะเกิดตรงส่วนของหมู่ฟังก์ชัน เช่น
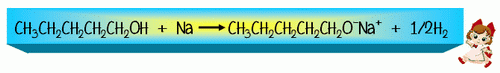
ตารางหมู่ฟังก์ชันบางชนิดและสารประกอบที่มีหมู่ฟังก์ชันเป็นองค์ประกอบ
ประเภทของสารประกอบไฮโดรคาร์บอน
สารประกอบไฮโดรคาร์บอน(Hydrocarbon compounds)หมายถึง สารประกอบที่มีเฉพาะคาร์บอนและไฮโดรเจนเป็นองค์ประกอบเท่านั้น
ประเภทของสารประกอบไฮโดรคาร์บอน
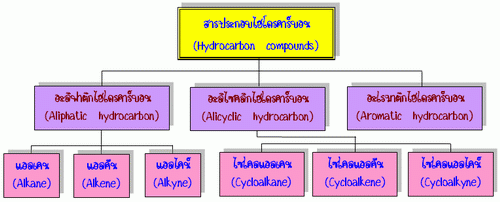
อะลิฟาติกไฮโดรคาร์บอน (Aliphatic hydrocarbon)เป็นสารประกอบที่คาร์บอนในโมเลกุลต่อกันเป็นโซ่เปิด (open chain) ได้แก่ แอลเคน แอลคีน และแอลไคน์
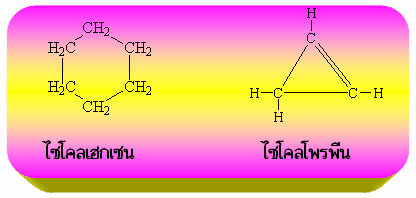
อะลิไซคลิกไฮโดรคาร์บอน (Alicyclic hydrocarbon)เป็นสารประกอบไฮโดรคาร์บอนที่มีโครงสร้างเป็นวงแหวนโดยที่คาร์บอนในวงแหวนเกาะกันด้วยพันธะเดี่ยวเป็นส่วนใหญ่ แต่อาจจะมีพันธะคู่หรือพันธะสามอยู่บ้าง เช่น
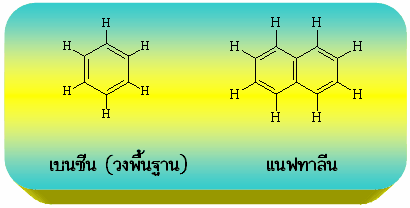
อะโรมาติกไฮโดรคาร์บอน (Aromatic hydrocarbon)เป็นสารประกอบไฮโดรคาร์บอนที่มีโครงสร้างเป็นวงหกเหลี่ยมเป็นพันธะคู่สลับกับพันธะเดี่ยว โดยสารที่เป็นอะโรมาติกไฮโดรคาร์บอนจะต้องมีโครงสร้างแบบนี้เป็นวงพื้นฐาน โดยตัวที่มีขนาดเล็กที่สุดจะเรียกว่าเบนซีน (Benzene) เช่น
6. การเรียกชื่อสารประกอบไฮโดรคาร์บอน
1.การเรียกชื่อสามัญ(Common name) ใช้เรียกชื่อสารประกอบอินทรีย์ที่มีโมเลกุลขนาดเล็ก ๆ และโครงสร้างโมเลกุลเป็นแบบง่าย ๆ ไม่มีหลักเกณฑ์แน่นอน เช่น กรดฟอร์มิก (HCOOH) กรดแอซีติก (CH3COOH) ซึ่งการเรียกชื่อสามัญจะตั้งชื่อตามแหล่งกำเนิดของสารประกอบ หรือตามชื่อของผู้ค้นพบ เมื่อการค้นพบสารประกอบอินทรีย์มากขึ้นเรื่อย ๆ การเรียกชื่อสาทัญอาจทำให้เกิดความสับสน
2.การเรียกชื่อระบบIUPACเป็นระบบการเรียกชื่อสารประกอบที่นักเคมีได้จัดระบบขึ้นในปี พ.ศ.2237 (ค.ศ.1892) เรียกระบบนี้ว่า International Union of Pure and Applied Chemistry หรือ IUPAC จะเรียกตามจำนวนอะตอมโดยใช้จำนวนนับในภาษากรีก ซึ่งประกอบด้วย 3 ส่วน คือ ส่วนที่ 1 โครงสร้างหลัก ส่วนที่ 2 คำลงท้าย ส่วน 3 คำนำหน้า
1) โครงสร้างหลัก เป็นส่วนที่แสดงลักษณะโครงสร้างหลักของคาร์บอนที่ต่อกันเป็นสายยาวที่สุด การเรียกชื่อโครงสร้างหลักจะเรียกตามจำนวนอะตอมของคาร์บอนที่ต่อกันเป็นสายยาวที่สุด โดยกำหนดการเรียกชื่อดังนี้
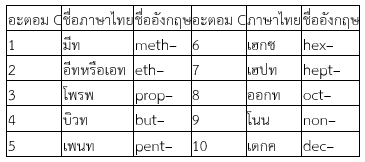
2) คำลงท้าย เป็นส่วนที่เติมท้ายชื่อของโครงสร้างหลักเพื่อแสดงว่าสารประกอบอินทรีย์นั้นเป็นสารประกอบประเภทใด คำลงท้ายจะบอกให้ทราบถึงชนิดของหมู่ฟังก์ชัน เช่น alkane ลงท้ายด้วย –ane หรือ alcohol ลงท้ายด้วย –ol เป็นต้น4) คำนำหน้า เป็นส่วนที่เติมหน้าชื่อของโครงสร้างหลัก จะบอกให้ทราบว่าในโครงสร้างหลักมีหมู่ฟังก์ชัน อะตอม หรือกลุ่มอะตอมใดมาเกาะบ้าง กี่หมู่ และอยู่ที่ C ตำแหน่งใดในโครงสร้างหลัก การบอกตำแหน่งของส่วนที่มาเกาะให้ใช้ตัวเลขน้อยที่สุด
3.2 ประเภทของสารประกอบไฮโดรคาร์บอน
สารประกอบไฮโดรคาร์บอนสามารถแบ่งได้เป็นประเภทต่าง ๆ ดังนี้
7. แอลกอฮอล์
เป็นสารประกอบอินทรีย์ที่เป็นอนุพันธ์ของสารประกอบไฮโดรคาร์บอนชนิดหนึ่งซึ่ง H ถูกแทนที่ด้วยหมู่ฟังก์ชัน –OH มีสูตรทั่วไปเป็น R–OH มีหมู่ไฮดรอกซิล (hydroxyl group ; –OH) เป็นหมู่ฟังก์ชัน การเรียกชื่อแอลกอฮอล์
ใช้เรียกแอลกอฮอล์โมเลกุลเล็ก ๆ ที่โครงสร้างโมเลกุลไม่ซับซ้อน เรียกชื่อหมู่แอลคิล (R) ที่ต่ออยู่กับหมู่ –OH ก่อน แล้วลงท้ายด้วยแอลกอฮอล์
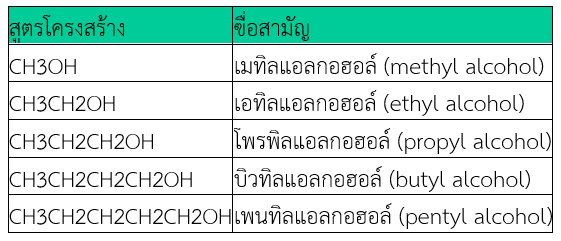
ชื่อระบบIUPAC
1. เลือกโครงสร้างหลักที่มีคาร์บอนต่อกันยาวที่สุด และมีหมู่ –OH อยู่ด้วย
2. บอกตำแหน่ง –OH ด้วยเลขที่มีค่าน้อยที่สุด
3. ชื่อโครงสร้างหลักให้เรียกตามจำนวนอะตอม C แล้วลงท้ายเสียงเป็น –อานอล (–anol)
สมบัติของแอลกอฮอล์
สมบัติทางกายภาพ
เมื่อแอลกอฮอล์ละลายน้ำ หมู่ –OH ในแอลกอฮอล์จะไม่แตกตัวเป็นไฮดรอกไซด์ไอออน (OH–) เช่นเดียวกับ OH–ในโลหะไฮดรอกไซด์ เช่น NaOH เนื่องจากพันธะระหว่างหมู่ –OH กับหมู่แอลคิลในแอลกอฮอล์เป็นพันธะโคเวเลนต์ แต่พันธะระหว่างหมู่ OH–กับโลหะไอออนเป็นพันธะไอออนิก โมเลกุลของแอลกอฮอล์มีทั้งส่วนที่มีขั้วคือหมู่ –OH และส่วนที่ไม่มีขั้วคือหมู่แอลคิล
1.จุดเดือด
จุดเดือดของแอลกอฮอล์จะเพิ่มขึ้นตามจำนวนอะตอมคาร์บอนที่เพิ่มขึ้น เพราะเมื่อจำนวนอะตอมคาร์บอนเพิ่มขึ้นมีผลให้มวลโมเลกุลมีค่าสูงขึ้น แรงยึดเหนี่ยวระหว่างโมเลกุลจึงสูงขึ้นด้วย เนื่องจากแอลกอฮอล์เป็นโมเลกุลมีขั้ว จึงมีทั้งแรงลอนดอนและแรงดึงดูดระหว่างขั้ว เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล นอกจากนี้หมู่ –OH สามารถเกิด พันธะไฮโดรเจน (Hydrogen bond) ยึดเหนี่ยวระหว่างโมเลกุลของแอลกอฮอล์ได้
การเกิดพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ
การเกิดพันธะไฮโดรเจนระหว่างโมเลกุลของแอลกอฮอล์
แอลกอฮอล์จึงมีจุดเดือดสูงกว่าแอลเคนที่มีจำนวนอะตอมคาร์บอนเท่ากัน เนื่องจากแอลเคนเป็นโมเลกุลไม่มีขั้ว จึงมีเฉพาะแรงลอนดอนเท่านั้น
2.การละลายน้ำ
แอลกอฮอล์ที่โมเลกุลมี C 1–3 อะตอม ละลายน้ำได้ดี เนื่องจากแอลกอฮอล์มีหมู่ –OH ซึ่งเป็นส่วนที่มีขั้วในโมเลกุลและเกิดพันธะไฮโดรเจนกับน้ำได้ จึงทำให้แอลกอฮอล์ละลายน้ำ แต่เมื่อมีจำนวนอะตอม C มากขึ้น จะละลายน้ำได้น้อยลง เนื่องจากเมื่อโมเลกุลมีขนาดใหญ่ขึ้น ส่วนที่ไม่มีขั้วมีมากขึ้น สภาพขั้วของโมเลกุลจะอ่อนลง ส่งผลให้ละลายน้ำได้น้อยลง นอกจากนี้การละลายน้ำของแอลกอฮอล์ยังขึ้นอยู่กับรูปร่างโมเลกุล ตำแหน่ง และจำนวนหมู่ –OH ด้วย
สมบัติทางเคมี
1.ปฏิกิริยาการเผาไหม้
แอลกอฮอล์สามารถติดไฟได้ดี ไม่มีเขม่าและควัน ได้ผลิตภัณฑ์เป็นแก๊สคาร์บอนไดออกไซด์และน้ำ เป็นปฏิกิริยาคายพลังงาน ดังสมการ CH3CH2OH(l) + 3 O2(g)--->2 CO2(g)+ 3 H2O(g)
2.ปฏิกิริยากับโลหะที่ว่องไว
แอลกอฮอล์ไม่เกิดปฏิกิริยากับ NaHCO3จึงไม่แสดงสมบัติเป็นกรด แต่สามารถเกิดปฏิกิริยากับโลหะที่ว่องไว (Active metal) เช่น Na โดยโลหะจะเข้าไปแทนที่อะตอมของ H ในหมู่ –OH จะได้แก๊สไฮโดรเจน ดังสมการ 2CH3CH2–OH(l)+2 Na(g)-->2 CH3CH2–ONa(l) + H2(g)
สมบัติและปฏิกิริยาของแอลกอฮอล์บางชนิด
1.เมทานอล(Methanol)
เป็นแอลกอฮอล์ที่มีจำนวนอะตอมคาร์บอนน้อยที่สุด เตรียมได้จากการเผาไม้ที่อุณหภูมิสูงในภาวะที่ปราศจากอากาศ ในอุตสาหกรรมเตรียมได้จากปฏิกิริยาระหว่างคาร์บอนมอนอกไซด์กับไฮโดรเจนภายใต้อุณหภูมิและความดันสูง โดยมีโลหะออกไซด์ เช่น Fe2O3, ZnO / Cr2O3 เป็นตัวเร่งปฏิกิริยา ดังสมการ CO + H2-------------> CH3OH
เมทานอลเป็นพิษต่อร่างกาย ถ้าเข้าสู่ร่างกายจะถูกออกซิไดส์กลายเป็นฟอร์มาลดีไฮด์ (HCHO) ซึ่งจะทำให้เกิดอาการปวดศีรษะ ตาบอด หรือเป็นอันตรายถึงชีวิต
ประโยชน์ของเมทานอล นำมาใช้เป็นตัวทำละลายอินทรีย์ เป็นเชื้อเพลิง เป็นสารตั้งต้นในการผลิตพลาสติก ยา และสารประกอบอินทรีย์ชนิดอื่น เช่น ฟอร์มาลดีไฮด์
2.เอทานอล(ethanol)
เป็นแอลกอฮอล์อีกชนิดหนึ่งที่นำมาใช้ประโยชน์ เตรียมไก้จากการหมักน้ำตาลที่ได้จากผลไม้ หรือแป้งจากธัญพืชในที่ปราศจากออกซิเจน เอนไซม์จากยีสต์หรือแบคทีเรียจะช่วยเร่งปฏิกิริยา ดังสมการ C6H12O6 -----> 2 CH3CH2OH +2CO2
เอทานอลที่ได้จากหมักน้ำตาลกับยีสต์นี้ใช้บริโภคในรูปของไวน์ เบียร์ และเหล้า ถ้าแต่บริโภคมาก ๆ จะเกิดอันตรายต่อร่างกาย ตับ และเกิดการเสพติด
เอทานอล แหล่งพลังงานใหม่ที่ยิ่งใหญ่ของโลก
ประโยชน์ของเอทานอล
1) ใช้เป็นตัวทำละลายในการผลิตน้ำหอมและยา
2) ใช้เป็นสารฆ่าเชื้อโรค
3) เอทานอลผสมกับน้ำมันเบนซินออกเทน 91 ในอัตราส่วนเอทานอล 1 ส่วน กับน้ำมันเบนซิน 9 ส่วน เป็นน้ำมันแก๊สโซฮอล์ ในปัจจุบันได้มีการพัฒนารถยนต์ให้สามารถใช้น้ำมันที่มีส่วนผสมของเอทานอล 20% เรียกว่า E-20 สำหรับรถบางรุ่นสามารถใช้น้ำมันเบนซินที่มีส่วนผสมของเอทานอลถึง 85% เรียกว่า E-85
อ้างอิง : SciMath : โดยคุณอนุสิษฐ์ เกื้อกูล ลิขสิทธิ์โดยสถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.)
เรื่อง : เคมีอินทรีย์ สารชีวโมเลกุลและผลิตภัณฑ์ปิโตรเลียม
หมายถึงสาขาวิชาที่เกี่ยวข้องกับการศึกษาเกี่ยวกับชนิด สมบัติ การสังเคราะห์ และปฏิกิริยาของสารประกอบอินทรีย์
สารอินทรีย์หมายถึงสารประกอบที่มีธาตุคาร์บอนเป็นองค์ประกอบ ทั้งที่เกิดจากสิ่งมีชีวิต และจากการสังเคราะห์ ยกเว้นสารต่อไปนี้ ซึ่งเป็นสารอนินทรีย์
- ออกไซด์ของคาร์บอน เช่น CO2
- เกลือคาร์บอเนต ( ) และไฮโดรเจนคาร์บอเนต ( ) เช่น แคลเซียมคาร์บอเนต (CaCO3) โซเดียมไฮโดรเจนคาร์บอเนต (NaHCO3)
- เกลือคาร์ไบด์ เช่น แคลเซียมคาร์ไบด์ (CaC2)
- เกลือไซยาไนด์ เช่น โพแทสเซียมไซยาไนด์ (KCN) , โซเดียมไซยาไนด์ (NaCN)
- เกลือไซยาเนต เช่น แอมโมเนียมไซยาเนต (NH4OCN)
- สารที่ประกอบด้วยธาตุคาร์บอนเพียงชนิดเดียว เช่น เพชร แกรไฟต์ ฟุลเลอรีน

Friedrich Wöhlerจากการศึกษาสารประกอบทั่ว ๆ ไป มักจะมีธาตุคาร์บอนเป็นองค์ประกอบ นักเคมีในยุคก่อนเชื่อว่าสารที่มีคาร์บอนเป็นองค์ประกอบต้องมาจากสิ่งมีชีวิตเท่านั้น และเรียกสารเหล่านี้ว่า สารประกอบอินทรีย์ จนกระทั่งปี พ.ศ. 2371 (ค.ศ.1828) ฟรีดริช เวอเลอร์ นักเคมีชาวเยอรมันสามารถสังเคราะห์สารอินทรีย์ได้จากสารอนินทรีย์ โดยสังเคราะห์ยูเรียซึ่งเป็นสารอินทรีย์จากการเผาแอมโมเนียมไซยาเนต (NH4OCN) ซึ่งเป็นสารอนินทรีย์ ดังสมการ NH4OCN(s) ----------> H2NCONH2(s)
ต่อมามีนักเคมีที่สามารถสังเคราะห์สารอินทรีย์ได้มากขึ้น จึงทำให้แนวคิดเกี่ยวกับสารอินทรีย์เปลี่ยนไปปัจจุบันจากการศึกษาสารประกอบทั่ว ๆ ไป มักจะมีธาตุคาร์บอนเป็นองค์ประกอบ นักเคมีในยุคก่อนเชื่อว่าสารที่มีคาร์บอนเป็นองค์ประกอบต้องมาจากสิ่งมีชีวิตเท่านั้น และเรียกสารเหล่านี้ว่า สารประกอบอินทรีย์
2. พันธะของคาร์บอน
เวเลนซ์อิเล็กตรอนทั้ง 4 ของคาร์บอนสามารถเกิดพันธะโคเวเลนซ์ (covalent bond) ได้ 4 พันธะ ซึ่งอาจจะเป็นพันธะเดี่ยว (single bond) พันธะคู่ (double bond) หรือพันธะสาม (triple bond) ก็ได้ การเกิดพันธะของคาร์บอนสามารถเกิดได้ 3 แบบ ดังนี้
พันธะเดี่ยว 4 พันธะ

พันธะคู่ 1 พันธะ + พันธะเดี่ยว 2 พันธะ

พันธะสาม 1 พันธะ + พันธะเดี่ยว 1 พันธะ

ความยาวพันธะระหว่างคาร์บอน - คาร์บอน เรียงจากน้อยไปมาก ดังนี้

พลังงานพันธะ900 600 300 kJ/molอะตอมอื่นๆ ที่มาร่วมใช้เวเลนซ์อิเล็กตรอนเกิดพันธะโคเวเลนซ์กับคาร์บอนในสารอินทรีย์ ธาตุที่พบมากที่สุด คือ ไฮโดรเจน (H) สำหรับธาตุอื่นๆ นอกจาก H แล้วยังมี ไนโตรเจน (N) , ฟอสฟอรัส (P), ออกซิเจน (O), กำมะถัน (S) และแฮโลเจน (F, Cl, Br, I) ตัวอย่างพันธะโคเวเลนต์ระหว่างคาร์บอนกับธาตุอื่นๆ ที่พบบ่อยในสารอินทรีย์ ดังนี้

ดังนั้นเมื่อเขียนสูตรสารอินทรีย์และมีอะตอมข้างบนนี้เข้ามาเกี่ยวข้องต้องพิจารณาจำนวนพันธะให้ถูกต้อง
กรดคาร์บอกซิลิก (Carboxylic acid)
กรดคาร์บอกซิลิก เป็นสารประกอบอินทรีย์ที่ประกอบด้วยธาตุ C H และ O โดยมีหมู่ฟังก์ชันคือหมู่คาร์บอกซิล (carboxyl : หรือ ) มีสูตรทั่วไปเป็น RCOOH หรือ หรือ RCO2H หรือ CnH2nO2เมื่อ R เป็นหมู่แอลคิล หมู่แอริล หรือไฮโดรเจน
การเรียกชื่อกรดคาร์บอกซิลิก
ชื่อสามัญ
1) ชื่อสามัญของกรดคาร์บอกซิลิก มักจะตั้งตามชื่อของสิ่งมีชีวิตหรือสิ่งของที่พบกรดชนิดนั้น เช่น กรดฟอร์มิก (formic acid) มาจากคำว่า fomica ในภาษาละตินที่มีความหมายว่า “มด” กรดแอซีติก (acetic acid) มาจากคำว่า acetumในภาษาละตินที่มีความหมายว่า “เปรี้ยว”2. การเรียกชื่อสามัญของกรดคาร์บอกซิลิกจะใช้อักษรกรีก เช่น แอลฟา (a) บีตา (b) และแกมมา (g) ระบุตำแหน่งของคาร์บอนที่ต้อกับหมู่คาร์บอกซิลตำแหน่งที่ 1 , 2 และ 3 ตามลำดับ เช่น
ดังนั้น กรดแอลฟาไฮดรอกซี จึงหมายกรดคาร์บอกซิลกที่มีหมู่ไฮดรอกซิล (-OH) ต่ออยู่กับอะตอมของคาร์บอนที่ตำแหน่งแอลฟา
| สูตรโครงสร้าง | ชื่อสามัญ |
| HCOOH | กรดฟอร์มิก (Formic acid) |
| CH3COOH | กรดแอซีติก (Acetic acid) |
| CH3CH2COOH | กรดโพรพิโอนิก (Propionic acid) |
| CH3CH2CH2COOH | กรดบิวทิลิก (Butylic acid) |
| CH3CH2CH2CH2COOH | กรดเพนทิลิก (Pentylic acid) |
การเรียกชื่อระบบ IUPAC
การเรียกชื่อกรดคาร์บอกซิลิกที่เป็นโซ่ตรง ให้เรียกตามจำนวนอะตอมคาร์บอน แล้วลงท้ายเสียงเป็น –อาโนอิก (–anoic acid) เช่น

กรดแอซีติก (กรดเอทาโนอิก)
กรดแอซีติก
กรดโพรพาโนอิก
3. สูตรโครงสร้างของสารอินทรีย์
การเขียนสูตรของสารประกอบอินทรีย์

สูตรโมเลกุลเป็นสูตรที่บอกให้ทราบว่าในสารประกอบนั้นประกอบด้วยธาตุใดบ้างอย่างละกี่อะตอม ซึ่งไม่เป็นที่นิยมเขียนสูตรชนิดนี้ เช่น CH4, C6H14, C6H6O เป็นต้น สูตรโครงสร้างเป็นสูตรที่บอกให้ทราบว่าในโมเลกุลของสารประกอบนั้น ประกอบด้วยธาตุใดบ้างอย่างละกี่อะตอม แต่ละอะตอมยึดเหนี่ยวกันอย่างไร มีหลายแบบ ดังนี้
สูตรโครงสร้างแบบเส้น (Expanded form) สูตรโครงสร้างแบบย่อ (Condensed form) สูตรโครงสร้างแบบเส้นและมุม (Bond - line form) เป็นการเขียนสูตรโครงสร้างโดยใช้เส้นขีด(-)แทนอิเล็กตรอน 2 ตัว หรือ 1 คู่ในการเขียนแสดงพันธะโคเวเลนต์ เช่น สูตรโครงสร้างแบบเส้น

สูตรโครงสร้างแบบย่อ (Condensed form)เป็นสูตรโครงสร้างที่ไม่แสดงเส้นพันธะเดี่ยวระหว่างไฮโดรเจนกับคาร์บอน โดยจะใช้วงเล็บย่อตัวที่เหมือนกันไว้ด้วยกัน เช่น

สูตรโครงสร้างแบบเส้นและมุม (Bond-line form) เป็นสูตรโครงสร้างที่ไม่แสดงธาตุคาร์บอนและไฮโดรเจน แต่จะแสดงเส้นพันธะระหว่างคาร์บอนและไฮโดรเจนเท่านั้น
4. ไอโซเมอริซึม
ไอโซเมอริซึม(Isomerism) และ ไอโซเมอร์(Isomer)ไอโซเมอริซึมคือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกันแต่สูตรโครงสร้างต่างกัน ทำให้มีสมบัติต่างๆ เช่น จุดเดือด จุดหลอมเหลวแตกต่างกัน ไอโซเมอร์คือ สารที่มีสูตรโมเลกุลเหมือนกันแต่มีสูตรโครงสร้างต่างกันหลักการพิจารณาว่าสารเป็นไอโซเมอร์กันหรือไม่
ขั้นที่ 1 พิจารณาจำนวนธาตุว่าเท่ากันหรือไม่ ถ้าเท่ากันให้นับจำนวนอะตอมของแต่ละชนิดว่าเท่ากันหรือไม่ ถ้าเท่ากันทุกธาตุแสดงว่ามีสูตรโมเลกุลเหมือนกัน ให้พิจารณาขั้นที่ 2 ต่อไป
ขั้นที่ 2 พิจารณาว่ามีโครงสร้างที่ต่างกันหรือไม่ ถ้ามีโครงสร้างต่างกันแสดงว่าเป็นไอโซเมอร์กัน ในการพิจารณาโครงสร้างว่าเหมือนกันหรือต่างกันเป็นเรื่องค่อนข้างยาก เพราะสูตรโครงสร้างที่นักเรียนเห็นไม่ใช่โครงสร้างที่แท้จริง แต่เป็นสูตรโครงสร้างที่เขียนเพื่อความสะดวก เป็นโครงสร้างเพียง 2 มิติ แต่ความเป็นจริง เป็นโครงสร้าง 3 มิติเป็นส่วนใหญ่ ดังนั้นสูตรโครงสร้างที่เห็นว่าต่างกันจึงอาจเหมือนกันได้ ในการพิจารณาใช้หลัก ดังนี้"ให้ถือว่าโครงสร้างทั้งหลายเป็นเส้นลวดที่สามารถตัด พลิก หมุนได้ (เฉพาะส่วนที่เกิดพันธะเดี่ยว) แต่ห้ามตัดต่อ พลิก หรือหมุนแล้วทำให้เหมือนกันแสดงว่าเป็นโครงสร้างเดียวกัน"
หลักการเขียนไอโซเมอร์
สารอินทรีย์ที่มีคาร์บอนอะตอมประมาณ 3-4 อะตอมขึ้นไปสามารถเกิดไอโซเมอร์ที่มีโครงสร้างแบบต่างๆ กัน ถ้าคาร์บอนอะตอมมากขึ้นก็จะมีจำนวน ไอโซเมอร์เพิ่มขึ้น แต่จะมีจำนวนเท่าไรไม่มีสูตรที่จะใช้ในการคำนวณที่แน่นอนและจะทราบจำนวนไอโซเมอร์ของสารอินทรีย์ได้ต้องเขียนและพิจารณาเองโดยมีหลักการเขียน ดังนี้
1. การเขียนไอโซเมอร์ต้องเริ่มจากไอโซเมอร์ที่มีคาร์บอนต่อกันเป็นสายยาวที่สุดก่อน
2. ลดจำนวนคาร์บอนอะตอมทีละอะตอมลงในสายยาวของคาร์บอนที่ต่อกัน โดยนำมาต่อเป็นสาขาที่ตำแหน่งต่าง ๆ
3. ต้องระวังพิจารณาว่ารูปร่างโครงสร้างที่เขียนซ้ำหรือไม่ การเขียนก็ให้เขียนเฉพาะคาร์บอนอะตอมก่อนแล้วจึงเติมไฮโดรเจนที่หลัง แล้วเช็คดูว่าสูตรตรงกับที่โจทย์ให้หรือไม่\ชนิดของไอโซเมอร์

Structural Isomer คือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกันแต่มีสูตรโครงสร้างต่างกัน

Chain Isomerism

Positional Isomerism

Functional Isomerism

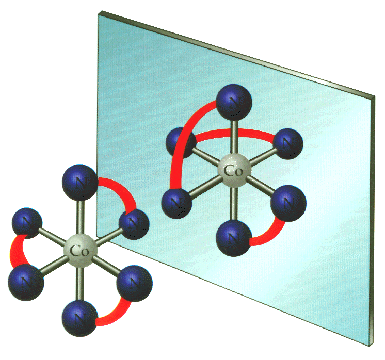
StereoIsomerismคือ ปรากฏการณ์ที่สารมีสูตรโมเลกุลเหมือนกัน สูตรโครงสร้างเหมือนกันแต่มีการจัดเรียงตัวของอะตอมหรือหมู่อะตอมในที่ว่าง (space) ต่างกัน


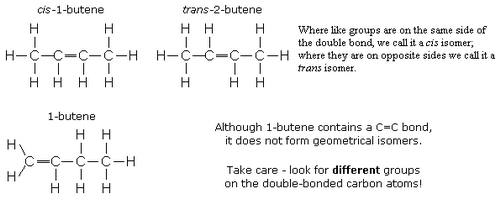
GeometricIsomerism

Optical Isomerism

5. หมู่ฟังก์ชัน
หมู่ฟังก์ชัน (Functional group = หมู่อะตอมที่แสดงสมบัติเฉพาะ)
หมู่ฟังก์ชันคือหมู่อะตอมหรือกลุ่มอะตอมของธาตุที่แสดงสมบัติเฉพาะของสารอินทรีย์ชนิดหนึ่งๆ เช่น CH3OH (เมทานอล) CH3CH2OH (เอทานอล) ซึ่งต้องเป็นสารอินทรีย์พวกแอลกอฮอล์ เพราะสารแต่ละชนิดต่างก็มีหมู่ -OH เป็นองค์ประกอบ แสดงว่าหมู่ -OH เป็นหมู่ฟังก์ชันของแอลกอฮอล์
HCOOH (กรดเมทาโนอิก) และ CH3COOH (กรดเอทาโนอิก) ซึ่งต่างจากกรดอินทรีย์ เพราะสารทั้งสองต่างก็มีหมู่ -COOH เป็นองค์ประกอบ แสดงว่าหมู่ -COOH เป็นหมู่ฟังก์ชันของกรดอินทรีย์
อนึ่งสารอินทรีย์โดยทั่วไปประกอบด้วยองค์ประกอบ 2 ส่วน ส่วนหนึ่งเป็นอะตอมไฮโดรคาร์บอนหรือหมู่อะตอมอื่นๆ อีกส่วนหนึ่งเป็นหมู่ฟังก์ชัน ซึ่งแสดงสมบัติเฉพาะของสารอินทรีย์นั้น และเป็นส่วนที่มีความว่องไวทางเคมี ดังรูป

ปฏิกิริยาเคมีที่เกิดกับสารอินทรีย์มักจะเกิดตรงส่วนของหมู่ฟังก์ชัน เช่น

ตารางหมู่ฟังก์ชันบางชนิดและสารประกอบที่มีหมู่ฟังก์ชันเป็นองค์ประกอบ

ประเภทของสารประกอบไฮโดรคาร์บอน
สารประกอบไฮโดรคาร์บอน(Hydrocarbon compounds)หมายถึง สารประกอบที่มีเฉพาะคาร์บอนและไฮโดรเจนเป็นองค์ประกอบเท่านั้น
ประเภทของสารประกอบไฮโดรคาร์บอน

อะลิฟาติกไฮโดรคาร์บอน (Aliphatic hydrocarbon)เป็นสารประกอบที่คาร์บอนในโมเลกุลต่อกันเป็นโซ่เปิด (open chain) ได้แก่ แอลเคน แอลคีน และแอลไคน์
อะลิไซคลิกไฮโดรคาร์บอน (Alicyclic hydrocarbon)เป็นสารประกอบไฮโดรคาร์บอนที่มีโครงสร้างเป็นวงแหวนโดยที่คาร์บอนในวงแหวนเกาะกันด้วยพันธะเดี่ยวเป็นส่วนใหญ่ แต่อาจจะมีพันธะคู่หรือพันธะสามอยู่บ้าง เช่น

อะโรมาติกไฮโดรคาร์บอน (Aromatic hydrocarbon)เป็นสารประกอบไฮโดรคาร์บอนที่มีโครงสร้างเป็นวงหกเหลี่ยมเป็นพันธะคู่สลับกับพันธะเดี่ยว โดยสารที่เป็นอะโรมาติกไฮโดรคาร์บอนจะต้องมีโครงสร้างแบบนี้เป็นวงพื้นฐาน โดยตัวที่มีขนาดเล็กที่สุดจะเรียกว่าเบนซีน (Benzene) เช่น

6. การเรียกชื่อสารประกอบไฮโดรคาร์บอน
1.การเรียกชื่อสามัญ(Common name) ใช้เรียกชื่อสารประกอบอินทรีย์ที่มีโมเลกุลขนาดเล็ก ๆ และโครงสร้างโมเลกุลเป็นแบบง่าย ๆ ไม่มีหลักเกณฑ์แน่นอน เช่น กรดฟอร์มิก (HCOOH) กรดแอซีติก (CH3COOH) ซึ่งการเรียกชื่อสามัญจะตั้งชื่อตามแหล่งกำเนิดของสารประกอบ หรือตามชื่อของผู้ค้นพบ เมื่อการค้นพบสารประกอบอินทรีย์มากขึ้นเรื่อย ๆ การเรียกชื่อสาทัญอาจทำให้เกิดความสับสน
2.การเรียกชื่อระบบIUPACเป็นระบบการเรียกชื่อสารประกอบที่นักเคมีได้จัดระบบขึ้นในปี พ.ศ.2237 (ค.ศ.1892) เรียกระบบนี้ว่า International Union of Pure and Applied Chemistry หรือ IUPAC จะเรียกตามจำนวนอะตอมโดยใช้จำนวนนับในภาษากรีก ซึ่งประกอบด้วย 3 ส่วน คือ ส่วนที่ 1 โครงสร้างหลัก ส่วนที่ 2 คำลงท้าย ส่วน 3 คำนำหน้า
1) โครงสร้างหลัก เป็นส่วนที่แสดงลักษณะโครงสร้างหลักของคาร์บอนที่ต่อกันเป็นสายยาวที่สุด การเรียกชื่อโครงสร้างหลักจะเรียกตามจำนวนอะตอมของคาร์บอนที่ต่อกันเป็นสายยาวที่สุด โดยกำหนดการเรียกชื่อดังนี้

2) คำลงท้าย เป็นส่วนที่เติมท้ายชื่อของโครงสร้างหลักเพื่อแสดงว่าสารประกอบอินทรีย์นั้นเป็นสารประกอบประเภทใด คำลงท้ายจะบอกให้ทราบถึงชนิดของหมู่ฟังก์ชัน เช่น alkane ลงท้ายด้วย –ane หรือ alcohol ลงท้ายด้วย –ol เป็นต้น4) คำนำหน้า เป็นส่วนที่เติมหน้าชื่อของโครงสร้างหลัก จะบอกให้ทราบว่าในโครงสร้างหลักมีหมู่ฟังก์ชัน อะตอม หรือกลุ่มอะตอมใดมาเกาะบ้าง กี่หมู่ และอยู่ที่ C ตำแหน่งใดในโครงสร้างหลัก การบอกตำแหน่งของส่วนที่มาเกาะให้ใช้ตัวเลขน้อยที่สุด
3.2 ประเภทของสารประกอบไฮโดรคาร์บอน
สารประกอบไฮโดรคาร์บอนสามารถแบ่งได้เป็นประเภทต่าง ๆ ดังนี้
- แอลเคน(Alkane)
- แอลคีน(Alkene)
- แอลไคน์(Alkyne)
- อะโรมาติกไฮโดรคาร์บอน(Aromatic hydrocarbon)
7. แอลกอฮอล์
เป็นสารประกอบอินทรีย์ที่เป็นอนุพันธ์ของสารประกอบไฮโดรคาร์บอนชนิดหนึ่งซึ่ง H ถูกแทนที่ด้วยหมู่ฟังก์ชัน –OH มีสูตรทั่วไปเป็น R–OH มีหมู่ไฮดรอกซิล (hydroxyl group ; –OH) เป็นหมู่ฟังก์ชัน การเรียกชื่อแอลกอฮอล์
ใช้เรียกแอลกอฮอล์โมเลกุลเล็ก ๆ ที่โครงสร้างโมเลกุลไม่ซับซ้อน เรียกชื่อหมู่แอลคิล (R) ที่ต่ออยู่กับหมู่ –OH ก่อน แล้วลงท้ายด้วยแอลกอฮอล์

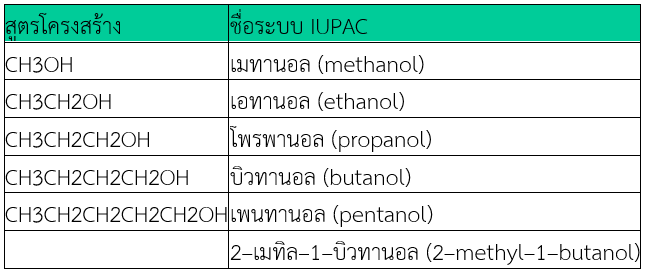
ชื่อระบบIUPAC
1. เลือกโครงสร้างหลักที่มีคาร์บอนต่อกันยาวที่สุด และมีหมู่ –OH อยู่ด้วย
2. บอกตำแหน่ง –OH ด้วยเลขที่มีค่าน้อยที่สุด
3. ชื่อโครงสร้างหลักให้เรียกตามจำนวนอะตอม C แล้วลงท้ายเสียงเป็น –อานอล (–anol)

สมบัติของแอลกอฮอล์
สมบัติทางกายภาพ
เมื่อแอลกอฮอล์ละลายน้ำ หมู่ –OH ในแอลกอฮอล์จะไม่แตกตัวเป็นไฮดรอกไซด์ไอออน (OH–) เช่นเดียวกับ OH–ในโลหะไฮดรอกไซด์ เช่น NaOH เนื่องจากพันธะระหว่างหมู่ –OH กับหมู่แอลคิลในแอลกอฮอล์เป็นพันธะโคเวเลนต์ แต่พันธะระหว่างหมู่ OH–กับโลหะไอออนเป็นพันธะไอออนิก โมเลกุลของแอลกอฮอล์มีทั้งส่วนที่มีขั้วคือหมู่ –OH และส่วนที่ไม่มีขั้วคือหมู่แอลคิล

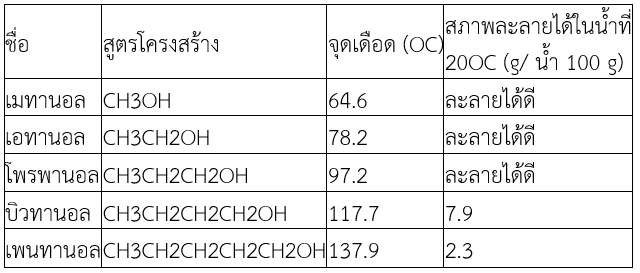
1.จุดเดือด
จุดเดือดของแอลกอฮอล์จะเพิ่มขึ้นตามจำนวนอะตอมคาร์บอนที่เพิ่มขึ้น เพราะเมื่อจำนวนอะตอมคาร์บอนเพิ่มขึ้นมีผลให้มวลโมเลกุลมีค่าสูงขึ้น แรงยึดเหนี่ยวระหว่างโมเลกุลจึงสูงขึ้นด้วย เนื่องจากแอลกอฮอล์เป็นโมเลกุลมีขั้ว จึงมีทั้งแรงลอนดอนและแรงดึงดูดระหว่างขั้ว เป็นแรงยึดเหนี่ยวระหว่างโมเลกุล นอกจากนี้หมู่ –OH สามารถเกิด พันธะไฮโดรเจน (Hydrogen bond) ยึดเหนี่ยวระหว่างโมเลกุลของแอลกอฮอล์ได้
การเกิดพันธะไฮโดรเจนระหว่างโมเลกุลของน้ำ
การเกิดพันธะไฮโดรเจนระหว่างโมเลกุลของแอลกอฮอล์
แอลกอฮอล์จึงมีจุดเดือดสูงกว่าแอลเคนที่มีจำนวนอะตอมคาร์บอนเท่ากัน เนื่องจากแอลเคนเป็นโมเลกุลไม่มีขั้ว จึงมีเฉพาะแรงลอนดอนเท่านั้น
2.การละลายน้ำ
แอลกอฮอล์ที่โมเลกุลมี C 1–3 อะตอม ละลายน้ำได้ดี เนื่องจากแอลกอฮอล์มีหมู่ –OH ซึ่งเป็นส่วนที่มีขั้วในโมเลกุลและเกิดพันธะไฮโดรเจนกับน้ำได้ จึงทำให้แอลกอฮอล์ละลายน้ำ แต่เมื่อมีจำนวนอะตอม C มากขึ้น จะละลายน้ำได้น้อยลง เนื่องจากเมื่อโมเลกุลมีขนาดใหญ่ขึ้น ส่วนที่ไม่มีขั้วมีมากขึ้น สภาพขั้วของโมเลกุลจะอ่อนลง ส่งผลให้ละลายน้ำได้น้อยลง นอกจากนี้การละลายน้ำของแอลกอฮอล์ยังขึ้นอยู่กับรูปร่างโมเลกุล ตำแหน่ง และจำนวนหมู่ –OH ด้วย
สมบัติทางเคมี
1.ปฏิกิริยาการเผาไหม้
แอลกอฮอล์สามารถติดไฟได้ดี ไม่มีเขม่าและควัน ได้ผลิตภัณฑ์เป็นแก๊สคาร์บอนไดออกไซด์และน้ำ เป็นปฏิกิริยาคายพลังงาน ดังสมการ CH3CH2OH(l) + 3 O2(g)--->2 CO2(g)+ 3 H2O(g)
2.ปฏิกิริยากับโลหะที่ว่องไว
แอลกอฮอล์ไม่เกิดปฏิกิริยากับ NaHCO3จึงไม่แสดงสมบัติเป็นกรด แต่สามารถเกิดปฏิกิริยากับโลหะที่ว่องไว (Active metal) เช่น Na โดยโลหะจะเข้าไปแทนที่อะตอมของ H ในหมู่ –OH จะได้แก๊สไฮโดรเจน ดังสมการ 2CH3CH2–OH(l)+2 Na(g)-->2 CH3CH2–ONa(l) + H2(g)
สมบัติและปฏิกิริยาของแอลกอฮอล์บางชนิด
1.เมทานอล(Methanol)
เป็นแอลกอฮอล์ที่มีจำนวนอะตอมคาร์บอนน้อยที่สุด เตรียมได้จากการเผาไม้ที่อุณหภูมิสูงในภาวะที่ปราศจากอากาศ ในอุตสาหกรรมเตรียมได้จากปฏิกิริยาระหว่างคาร์บอนมอนอกไซด์กับไฮโดรเจนภายใต้อุณหภูมิและความดันสูง โดยมีโลหะออกไซด์ เช่น Fe2O3, ZnO / Cr2O3 เป็นตัวเร่งปฏิกิริยา ดังสมการ CO + H2-------------> CH3OH
เมทานอลเป็นพิษต่อร่างกาย ถ้าเข้าสู่ร่างกายจะถูกออกซิไดส์กลายเป็นฟอร์มาลดีไฮด์ (HCHO) ซึ่งจะทำให้เกิดอาการปวดศีรษะ ตาบอด หรือเป็นอันตรายถึงชีวิต
ประโยชน์ของเมทานอล นำมาใช้เป็นตัวทำละลายอินทรีย์ เป็นเชื้อเพลิง เป็นสารตั้งต้นในการผลิตพลาสติก ยา และสารประกอบอินทรีย์ชนิดอื่น เช่น ฟอร์มาลดีไฮด์
2.เอทานอล(ethanol)
เป็นแอลกอฮอล์อีกชนิดหนึ่งที่นำมาใช้ประโยชน์ เตรียมไก้จากการหมักน้ำตาลที่ได้จากผลไม้ หรือแป้งจากธัญพืชในที่ปราศจากออกซิเจน เอนไซม์จากยีสต์หรือแบคทีเรียจะช่วยเร่งปฏิกิริยา ดังสมการ C6H12O6 -----> 2 CH3CH2OH +2CO2
เอทานอลที่ได้จากหมักน้ำตาลกับยีสต์นี้ใช้บริโภคในรูปของไวน์ เบียร์ และเหล้า ถ้าแต่บริโภคมาก ๆ จะเกิดอันตรายต่อร่างกาย ตับ และเกิดการเสพติด
เอทานอล แหล่งพลังงานใหม่ที่ยิ่งใหญ่ของโลก
ประโยชน์ของเอทานอล
1) ใช้เป็นตัวทำละลายในการผลิตน้ำหอมและยา
2) ใช้เป็นสารฆ่าเชื้อโรค
3) เอทานอลผสมกับน้ำมันเบนซินออกเทน 91 ในอัตราส่วนเอทานอล 1 ส่วน กับน้ำมันเบนซิน 9 ส่วน เป็นน้ำมันแก๊สโซฮอล์ ในปัจจุบันได้มีการพัฒนารถยนต์ให้สามารถใช้น้ำมันที่มีส่วนผสมของเอทานอล 20% เรียกว่า E-20 สำหรับรถบางรุ่นสามารถใช้น้ำมันเบนซินที่มีส่วนผสมของเอทานอลถึง 85% เรียกว่า E-85
อ้างอิง : SciMath : โดยคุณอนุสิษฐ์ เกื้อกูล ลิขสิทธิ์โดยสถาบันส่งเสริมการสอนวิทยาศาสตร์และเทคโนโลยี (สสวท.)
เรื่อง : เคมีอินทรีย์ สารชีวโมเลกุลและผลิตภัณฑ์ปิโตรเลียม